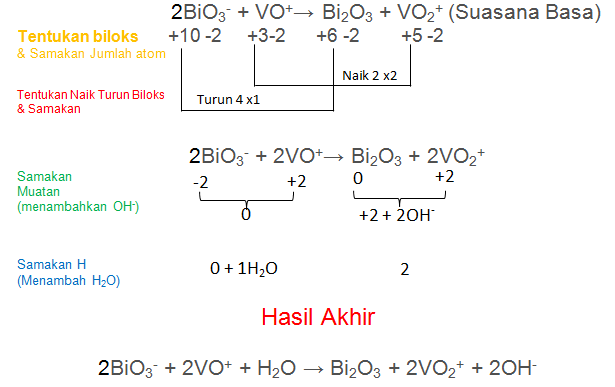
1. Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana basa)
Jawaban:
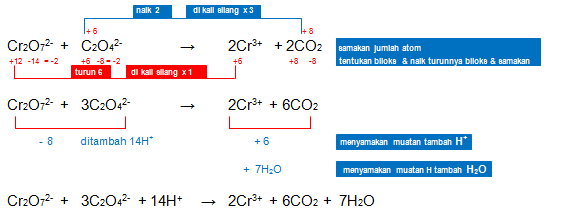
2. Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana asam)
Jawaban:
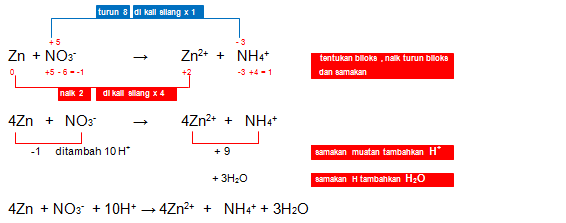
3. Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana asam)
Jawaban:
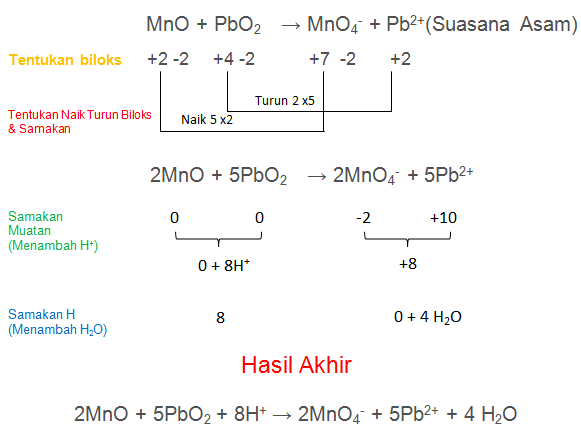
4. Setarakan reaksi redoks berikut dengan menggunakan metode bilangan oksidasi! (suasana asam)
Jawaban:
Reaksi Redoks via https://tanya-tanya.com/